Ал2(ЅО4)3 молярная масса и структурная формула
Опубликованно 07.01.2019 00:35
Аль -2(настолько4)3 алюминия сульфат неорганическое вещество из класса солей. Встречается в виде кристаллов или белого порошка, хорошо растворяется в воде. Химически активное вещество, легко реагирует со многими компонентами, поэтому его часто используют в экспериментах и задачах в химии, но нужно знать, молярная масса Аш2(настолько4)3. Расчет индекса
Относительная молекулярная масса сульфата алюминия объем одной молекулы вещества. Внимательнее посмотрим.
Данный показатель выражается в атомных единицах массы (а.е.м.). Нетрудно подсчитать, используя периодическую систему элементов Менделеева, зная формулу вещества.
Вам нужно найти в таблице элементы, которые составляют наше вещество - алюминия, серы и кислорода. Относительная масса одного атома алюминия 26,992.е.м. (с округлением до 27), то атом серы 32,064 (с округлением до 32), атом кислород 15,999 (округленное до 16).
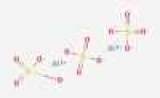
Молекула, формула сульфата алюминия на рисунке ниже. Это показывает, молекул и сколько атомов каждого из элементов, участвующих в формировании одной условной молекулы вещества.
Затем нужно умножить массу одного атома алюминия число этих частиц в молекуле Ал2(настолько4)3. Этот номер указывается индексом справа от символа алюминий 2. Умножить 2 на 27, мы получим 54.е.м.
Затем повторите с атомом серы. Молекула сернокислого алюминия состоит из трех частиц (4), и, следовательно, три атома серы. Умножьте 32 на 3, получаем 96.е.м.
Такой же расчет производится с атомами кислорода. Сначала подсчитаем, сколько из них включено в состав молекулы. Он состоит из трех частиц (4), т. е. 12 атомов кислорода. Умножьте вес на количество атомов 16 на 12, получаем 192.е.м.
Последний шаг-сложить массы всех составных частей молекулы:
54 + 96 + 192 = 342.е.м.
Таким образом, молекулярная масса сульфата алюминия 342.е.м. На следующем рисунке
Молярная масса ал2 ѕо4 3-объем одного моля сульфата алюминия. Это очень легко узнать, так как она численно равна молекулярной массе, но выражается в других единицах измерения г/моль.
Так, молярная масса ал2 ѕо4 3 равна 342 г/моль. Это значение часто требуется для решения проблемы.
Молярная масса эквивалента
Чтобы вычислить это значение, нужно знать фактор эквивалентности. Она определяется по-разному для классов веществ.
Сульфат алюминия относятся к группе средних солей. Для таких соединений, фактор эквивалентности рассчитывается следующим образом: Вам нужно разделить единицы продукции на количество атомов металла и заряда металла. Найти продукт. Атомы металлического алюминия в молекуле или два, это видно из Формулы. Заряд из алюминия постоянна и равна трем, то есть 2 * 3 = 6. Фактор эквивалентности солей сульфата алюминия равна 1/6.
Чтобы найти молярную массу эквивалента сульфата алюминия, молярная масса умножить его на коэффициент эквивалентности:
342 * 1 / 6 = 57 г/моль.
Таким образом, молярную массу эквивалента Ал2 (ЅО4) 3 равна 57 г/моль.
Расчеты закончены, желаемой стоимости. Автор: Светлана Шукшина 14 ноября 2018
Категория: Культура


